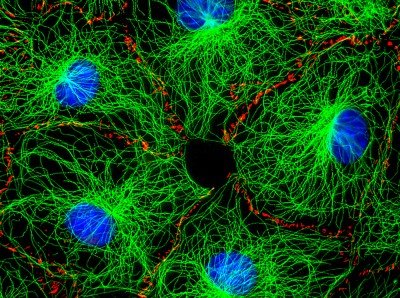
Un Mundo Microscópico Brillante: La Química de la Fluorescencia
La microscopía de fluorescencia es una de las herramientas más poderosas en el kit de herramientas de las ciencias de la vida. Las propiedades espectrales únicas de colorantes y proteínas fluorescentes, colectivamente llamados fluoróforos, han permitido a los científicos capturar instantáneas, e incluso películas, del universo microscópico que impulsa la biología. Sin embargo, los científicos siguen perplejos por la química fundamental que mantiene encendidas las luces.
Todos los fluoróforos funcionan en el mismo principio: la energía absorbida de un fotón entrante excita a la molécula a un estado más energético. A medida que el fluoróforo «se relaja», disipa energía emitiendo un nuevo fotón de una longitud de onda diferente (más larga). Cuanto más eficientemente un fluoróforo absorba fotones y emita luz, más fuerte será su señal fluorescente.
El problema es que los fluoróforos no pueden realizar este espectáculo de luz para siempre: se desvanecen con el tiempo en un fenómeno llamado foto-bleaching. El foto-bleaching ocurre más rápidamente con la luz de alta intensidad y después de rondas repetidas de excitación y en entornos ricos en oxígeno. Esto puede terminar experimentos prematuramente y a veces genera subproductos tóxicos que pueden matar células. Algunos de los primeros colorantes se desvanecían en segundos bajo una luz brillante, mientras que muchos de los fluoróforos actuales pueden mantenerse brillantes durante minutos o más bajo las condiciones adecuadas.
El foto-bleaching se ha convertido en un rompecabezas irritante en el mundo de la bioimagen, pero no es ni glamoroso ni fácil de resolver. Mucho se desconoce sobre la química que lo impulsa o lo previene, según Luke Lavis, un químico orgánico en el Instituto Médico Howard Hughes en el Janelia Research Campus en Virginia. Las estrategias que fortalecen un fluoróforo contra el bleaching podrían afectar inadvertidamente otras características espectrales. Y los cambios que mejoran un fluoróforo pueden ser difíciles de aplicar a otros. «Es algo con lo que la gente simplemente convive en lugar de intentar estudiarlo realmente», dice Adam Cohen, un neurocientífico de la Universidad de Harvard en Massachusetts.
Encendiendo las Luces
Los microscopistas tienen una amplia paleta de colorantes y proteínas fluorescentes a su disposición. El proveedor de microscopios Leica Microsystems, con sede en Wetzlar, Alemania, enumera más de 250 colorantes fluorescentes para imagen en ciencias de la vida, y la base de datos de proteínas fluorescentes FPbase incluye casi 1,100 entradas. Los colorantes fluorescentes son descendientes de la industria de colorantes del siglo XIX, cuando los químicos estaban aprendiendo a fabricar pequeñas moléculas orgánicas como fluoresceína, rodamina y colorantes de cianina. Las proteínas fluorescentes provienen del descubrimiento en 1962 de que ciertas medusas fluorescen porque contienen una familia de proteínas en la cual una molécula de color llamada cromóforo, construida a partir de aminoácidos, está encerrada en un barril protector formado a partir de una estructura de proteína llamada hojas β-plegadas (posteriormente también se descubrió que los corales contienen la misma familia de proteínas).
Sea cual sea su naturaleza química, estas moléculas son impulsadas por los mismos principios fotofísicos. Cuando una molécula es iluminada por luz entrante, la energía del fotón absorbido excita electrones en el material. El fluoróforo no puede retener esa energía para siempre: el tiempo que pasa en el estado excitado se llama tiempo de vida de fluorescencia. Eventualmente, debe relajarse, idealmente liberando esa energía acumulada como fotones irradiados: se libera un fotón por cada fotón absorbido.
En la práctica, los electrones excitados encuentran numerosas vías no radiativas para regresar a su estado fundamental, su nivel de energía normal, sin emitir un fotón. El fluoróforo podría perder energía a través de colisiones con otras moléculas o a través de vibraciones en sus propios enlaces, por ejemplo. Las fotoreacciones fuera del objetivo podrían generar especies reactivas de oxígeno tóxicas o incluso destruir el fluoróforo. En ambos casos, la fluorescencia se extingue temporalmente o permanentemente, y el rendimiento cuántico, la relación entre la fluorescencia emitida y la luz de excitación, se ve afectado.
Puedes encontrar más información sobre la fluorescencia en la ciencia de la vida en este [sitio web](#)
Química Avanzada para una Imagen Biológica Mejor
Proteínas fluorescentes y colorantes tienen sus ventajas. Las proteínas pueden expresarse en tipos celulares específicos, mientras que los colorantes, al ser moléculas pequeñas, son más brillantes y se pueden afinar más fácilmente a través de la síntesis. Ahora, los investigadores han desarrollado un sistema de fluoróforos que combina lo mejor de ambos, según Frei. Proteínas de autoetiquetado, como los reactivos SNAP-tag y HaloTag disponibles comercialmente, funcionan mediante la inserción de una etiqueta de proteína enzimática en un objetivo de interés. Esta proteína etiquetada luego se puede acoplar a cualquiera de varios pequeños moléculas fluorescentes suministradas por el investigador. Para Frei, este diseño proporciona una plataforma para la imagen de vida de fluorescencia (FLIM), un método intensivo en fotones que diferencia los fluoróforos por el tiempo que pasan en el estado excitado en lugar de la longitud de onda que emiten.
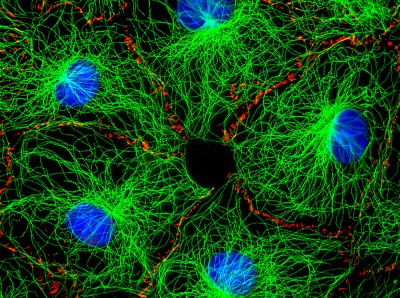
Micrografía de inmunofluorescencia de células de fibroblastos coloreadas de verde brillante, azul y rojo
Para sacar el máximo provecho de estos sistemas de autoetiquetado, sin embargo, los colorantes fluorescen